Programa Educacional em Vigilância e Cuidado em Saúde no Enfrentamento da COVID-19 e de outras Doenças Virais
Unidade 1 – Arbovírus
O vírus oropouche é um membro do gênero Orthobunyavirus, que foi isolado pela primeira vez em Trindade e Tobago, em 1955, em soro de trabalhador rural que residia numa vila chamada Vega de Oropouche. Posteriormente, houve outro isolado em pool de 177 mosquitos Coquillettidia venezuelensis, coletados na floresta Bush, em Trindade, em 1960. Pertence ao sorogrupo Simbu, constituído de 25 vírus classificados em sete complexos e dois subclados filogenéticos, denominados subclado A, Manzanilla e Oropouche, e subclado B, Simbu, Akabane, Sathuperi, Shamonda e Shuni. Uma das características do sorogrupo Simbu é a sua grande diversidade genética que é atribuída à ampla distribuição geográfica. Dos vírus do subclado A, 77% têm sido isolados na América, Austrália, África do Sul e no Vietnã. O complexo Oropouche é o único que inclui espécies que afetam o homem: Oropouche, Jatobal, Iquitos, Leanyer, Oya e Thimiri (SAKKAS et al., 2018).
Em 2000, do ponto de vista filogenético, foram diferenciados três genótipos (I, II e III) do vírus no Brasil, Peru e Panamá, e, dez anos depois, um quarto genótipo foi relatado no Brasil. O genótipo I inclui linhagens isoladas nos estados do Acre, Amazonas, Maranhão, Tocantins e Pará, assim como em Trindade e Tobago, e é o mais disperso pelo Brasil. O genótipo II foi inicialmente encontrado nos estados brasileiros do Pará, Amapá e Rondônia, assim como no Peru. O genótipo III foi isolado no Acre, Minas Gerais e Rondônia, no Brasil, e no Panamá. Por último, o genótipo IV foi isolado no estado do Amazonas, no Brasil (SAKKAS et al., 2018).
O vírus oropouche tem dois ciclos de transmissão. No ciclo silvestre, há evidências de que o bicho-preguiça, os primatas não humanos e algumas espécies de pássaros são os principais hospedeiros vertebrados do vírus. O vetor nesse ciclo não está claro ainda, porém, em duas ocasiões, foi isolado de pool de mosquitos de Ochlerotatus serratus na região Amazônica e de Coquilletidia venezuelensis em Trindade e Tobago. No ciclo urbano ou epidêmico, os humanos são os principais hospedeiros, e o vetor principal é o Culicoides paraensis da família Ceratopogonidae, tradicionalmente chamado de maruim, e o mosquito Culex quinquefasciatus (TRAVASSOS DA ROSA et al., 2017).
-
Patogênese e sintomas na infecção pelo vírus oropouche
Não existe informação precisa sobre o período de incubação intrínseca do vírus oropouche, porém alguns estudos realizados durante as epidemias sugerem que pode variar de 4 a 8 dias. Adicionalmente, estudos experimentais em hamsters demonstraram que o período de incubação extrínseca é de 5 dias ou mais.
Os sintomas são observados nos primeiros 2 a 4 dias da infecção, com viremia detectável. Após percorrer a corrente sanguínea, o vírus infecta as células do Sistema Nervoso Central (SNC), gerando resposta inflamatória. Experimentos realizados com camundongos infectados demonstraram severas manifestações de encefalite relacionadas à dispersão do vírus para o parênquima cerebral. Em outros estudos, o vírus foi detectado em lesões do fígado com significativa necrose dos hepatócitos (TRAVASSOS DA ROSA et al., 2017). Com relação aos sintomas, normalmente as infecções pelo vírus oropouche vêm acompanhadas de dores de cabeça, mialgia, artralgia, anorexia, tontura, arrepios e fotofobia. Alguns pacientes relatam rash, náusea, vômitos, diarreia, conjuntivite, dor epigástrica e dor retro-orbital. A recorrência dos sintomas é frequente poucos dias após o início dos primeiros sinais, porém com menor intensidade. Alguns pacientes desenvolvem meningite. A convalescência é completa, sem aparente sequela, inclusive nos casos severos. Não há relatos de óbitos associados à infecção pelo vírus, porém a detecção do vírus no fluido cerebroespinhal em pacientes do estado do Amazonas sugere que a severidade da doença comprometa o SNC (TRAVASSOS DA ROSA et al., 2017; SAKKAS et al., 2018).
-
Diagnóstico laboratorial do vírus oropouche
O diagnóstico clínico da doença é complicado nas regiões endêmicas pelo fato de os sintomas serem similares aos das infecções por dengue, zika, chikungunya, febre amarela e malária. As técnicas utilizadas para o diagnóstico laboratorial são as mesmas mencionadas na seção 1.4.1.2.2. No teste ELISA são usados antígenos do vírus que detectam anticorpos IgM e IgG contra o patógeno. Da mesma forma, no teste RT-PCR em tempo real são usados oligonucleotídeos específicos que detectam o vírus em amostras de soro coletadas.
Saiba mais
Conheça a história do vírus oropouche no Brasil
Foi isolado no Brasil em 1960 em soro de bicho-preguiça Bradypus trydactylus capturado em região de floresta durante a construção da BR Belém-Brasília e em pool de mosquitos Ochlerotatus serratus coletados numa região próxima. No ano seguinte, o vírus foi detectado na cidade de Belém, no Pará, durante surto relatado na cidade que acometeu 11.000 pessoas. A partir desse momento ficou demonstrado o potencial epidêmico do vírus.
Outros surtos foram descritos nos estados do Acre, Amapá, Amazonas, Maranhão, Pará, Rondônia e Tocantins, no ano de 1989. Mais recentemente, o vírus foi relatado em diferentes municípios do estado do Pará. Em 2009, outro surto da doença foi reportado nos municípios de Altamira e Santa Bárbara, no Pará, e em Mazagão, no Amapá.
Na Tabela 1, são mostrados, de forma resumida, diferentes aspectos do ciclo de transmissão dos Flavivirus, Alphavirus e Orthobunyavirus tratados nesta unidade, com o objetivo de facilitar a compreensão das semelhanças e diferenças entre esses arbovírus.
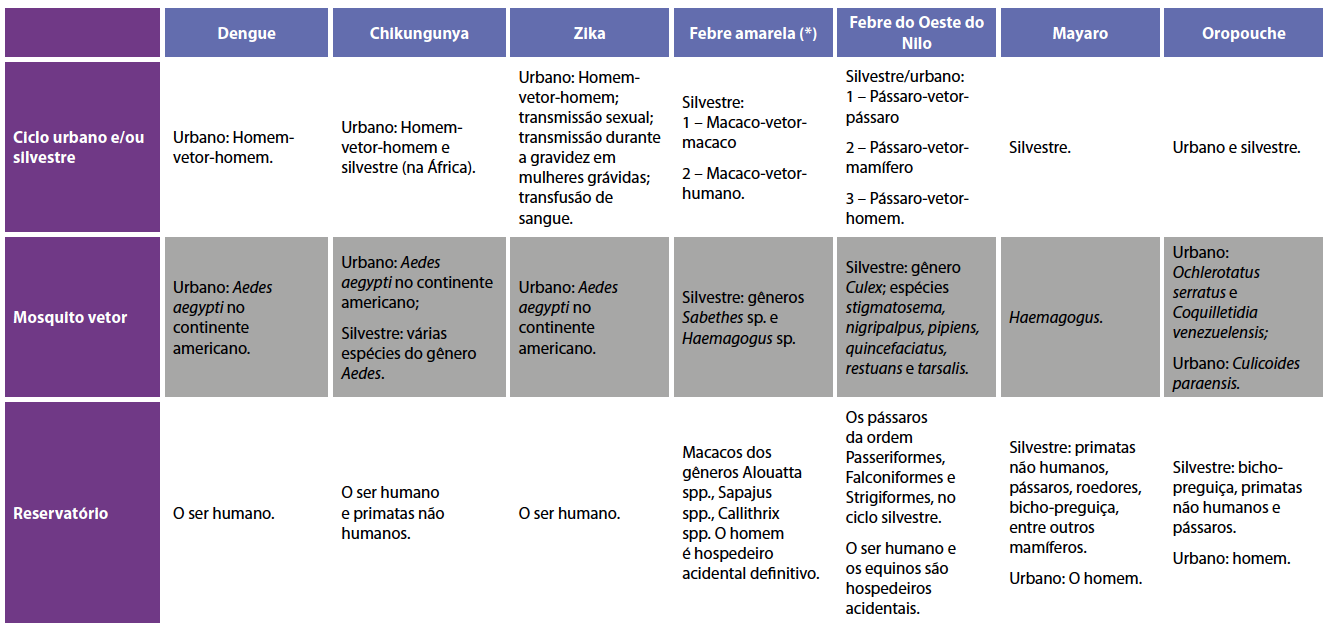 (*) A febre amarela urbana foi erradicada do Brasil na
década de 1940 e era transmitida pelo mosquito Aedes aegypti para os seres
humanos.
(*) A febre amarela urbana foi erradicada do Brasil na
década de 1940 e era transmitida pelo mosquito Aedes aegypti para os seres
humanos.
Para finalizar a unidade, vamos falar do tratamento das arboviroses e das medidas que permitem controlar a circulação e disseminação desses arbovírus.
1.4.1.5 Tratamento das arboviroses
Não existe tratamento antiviral específico para as arboviroses. O tratamento é realizado com base nos sintomas relatados pelo paciente, sendo recomendado repouso e reposição de líquidos. Analgésicos e antitérmicos como dipirona e paracetamol podem ser prescritos para controlar a dor e a febre, e anti-histamínicos orais, para o controle do rash e prurido. O tratamento das náuseas e vômitos é feito com antieméticos, sendo a metoclopramida a droga de eleição. Recomenda-se não usar medicamentos que contenham em sua fórmula ácido acetilsalicílico ou derivados pela possibilidade de gerar ou agravar o quadro hemorrágico (SAKKAS et al., 2018; DIAGNE et al., 2020; BRASIL, 2017, 2004).
No caso de dores articulares provocadas pelas infecções por dengue, chikungunya e mayaro, é importante ter uma ferramenta (escala analógica visual – EVA) que permite a aferição da dor, transformando um dado subjetivo em um dado objetivo, o que possibilita avaliar e conduzir adequadamente o caso. Na dor causada pela infecção por chikungunya na fase aguda, os anti-inflamatórios não hormonais (AINH) não devem ser prescritos devido ao risco de sangramento desses pacientes. Na presença de dor leve a moderada, recomenda-se o uso de dipirona ou paracetamol. Em caso de dor persistente, poliarticular ou incapacitante, pode ser necessário o uso de medicações intravenosas. Se as dores forem intensas, além dos analgésicos, podem ser prescritos opioides (SAKKAS et al., 2018; DIAGNE et al., 2020; BRASIL, 2017, 2004).
No caso de o paciente desenvolver a síndrome de Guillain-Barré, provocada principalmente pelo vírus zika, o tratamento na fase aguda, devido à natureza autoimune da doença, consiste em imunoterapia, como plasmaférese ou aplicação de imunoglobulina, que ajudam a remover os anticorpos da corrente sanguínea e substituí-los por plasma artificial, usualmente albumina (SAKKAS et al., 2018; DIAGNE et al., 2020; BRASIL, 2017, 2004).
Independentemente da arbovirose, é importante que qualquer pessoa sintomática procure atendimento médico e não se automedique.
1.4.1.6 Medidas de controle das arboviroses
Nas áreas urbanas, as medidas comunitárias de controle visam controlar o vetor, entre elas: saneamento básico; eliminação dos focos do vetor nas residências e área comuns; redução do acúmulo de lixo por meio de campanhas de limpeza urbana para eliminar os lugares em que a fêmea do mosquito possa colocar os ovos; uso de adulticidas e larvicidas para diminuir a densidade do mosquito e bloquear os focos de transmissão. Por outro lado, também existem medidas de prevenção individuais que são recomendadas: usar camisa de manga comprida e calças em lugares endêmicos e onde há grande densidade de mosquitos; utilizar tela nas portas e janelas para evitar a entrada de mosquitos; usar repelentes contra insetos seguindo as orientações da bula; vestir as crianças com roupas que cubram braços e pernas; usar mosquiteiros nos berços e camas (BRASIL, 2017, 2004). Mais detalhes sobre o controle desses vetores poderão ser vistos nas Unidades 3 e 4.
No caso dos arbovírus que circulam em áreas silvestres e que podem afetar o homem, os cuidados individuais devem ser considerados. Porém, alguns vírus, como o mayaro e o oropouche, podem ser “urbanizados” e produzir surtos. Nesse sentido, alguns aspectos devem ser observados: 1) a urbanização pode ser o resultado do “transporte” do vírus para as cidades por humanos ou pássaros infectados; 2) a presença de mosquitos nas cidades, Aedes aegypti, Culex quinquefasciatus e Aedes albopictus, que têm a capacidade de se infectar e transmitir alguns vírus que circulam nas áreas silvestres; 3) as mudanças do ambiente natural por ação do homem (desmatamento, atividades agrícolas, crescimento das cidades, entre outras); 4) mutações genéticas dos arbovírus e as suas adaptações a vetores urbanos; 5) o incremento da tolerância e seleção de resistência dos vetores a doses letais de inseticidas (adulticidas e larvicidas); 6) as mudanças climáticas que favorecem a invasão dos vetores em áreas onde os vírus não circulavam (SAKKAS et al., 2018; DIAGNE et al., 2020).
A febre amarela pode ser controlada por meio da vacinação contra o vírus, que é ofertada à população pelo SUS. Desde 2017, o Brasil adota o esquema vacinal de apenas uma dose para toda a vida, mas, seguindo as recomendações da Organização Mundial da Saúde (OMS), uma dose de reforço é indicada para a pessoa – independentemente da idade que tiver – que recebeu a vacina antes de completar cinco anos. A vacina é produzida no Brasil desde 1937 pelo Instituto de Tecnologia em Imunobiológicos Bio-Manguinhos (Fiocruz) e é da cepa 17DD. É produzida com vírus vivos atenuados derivados de uma amostra africana do vírus amarílico selvagem denominado Asibi. Pode ser aplicada na população a partir dos 9 meses de idade, sem limite de idade. A administração é subcutânea. A imunidade ocorre a partir do 10º dia após a vacinação, perdurando por toda a vida (BRASIL, 2020).
Estão em fase de desenvolvimento vacinas contra o vírus Dengue. O Instituto Butantan desenvolveu a vacina Butantan-DV que mostrou uma eficácia de 79,6%. A vacina é tetravalente, composta pelos quatro sorotipos do vírus da dengue, atenuados. A pesquisa clínica se encontra na fase 3, onde o novo pro- duto é avaliado em pacientes voluntários, analisando o tipo e o perfil das reações adversas mais frequentes, de forma aleatória e por sorteio, comparando com o grupo controle. O acompanhamento vem sendo realizado em mais de 16 mil indivíduos de todo o Brasil, com idades entre 2 e 59 anos. O imunizante foi administrado, em dose única, em 10.259 pessoas e o restante recebeu placebo. Até o presente momento não foi reportado nenhum caso grave de dengue nos participantes. O estudo terá continuidade até todos os indivíduos completarem cinco anos de acompanhamento (2024). Adicionalmente, a eficácia da vacina foi avaliada em voluntários que estiveram expostos ao vírus da dengue. Em pessoas que contraíram a doença antes da pesquisa, a proteção foi de 89,2% e naqueles que tiveram contato com o vírus sem apresentar a doença, a eficácia foi de 73,5% (https://revistapesquisa.fapesp.br/).
A farmacêutica japonesa Takeda desenvolveu uma vacina chamada QDenga ou TAK-003, feita com uma cepa atenuada do sorotipo 2 do vírus fornecendo “o suporte” genético de proteção contra os quatro sorotipos. A vacina, aplicada em duas doses, demonstrou uma eficácia de 80% na prevenção da febre causada pela dengue. O estudo está sendo realizado em oito países da América Latina e da região Ásia-Pacífico. As fases 1 e 2 do estudo clínico demonstraram boa tolerância nos voluntários, alta resposta humoral contra os quatro sorotipos e longa persistência dos anticorpos gerados após aplicação. Na fase 3 da pesquisa já foram avaliados mais de 28 mil crianças e adultos, totalizando 4 anos de estudo, evitando 84% dos casos de dengue hospitalizados e 61% de casos sintomáticos na população geral, incluindo indivíduos soropositivos e soronegativos, que persistiu por 48 meses após a vacinação. Em dezembro de 2021, a Agência Europeia de Medicamentos (EMA, em inglês) autorizou o uso da QDenga na população acima de 4 anos de idade. Em março deste ano, a Anvisa aprovou por meio da resolução RE 661/23, o registro que permite a comercialização do produto no Brasil. (LÓPEZ-MEDINA et al, 2022; https://portalcorreio.com.br/; BRASIL, 2023).
O Instituto Butantan em parceria com a empresa farmacêutica Valneva Áustria Gmb desenvolveu uma vacina, de vírus atenuado, contra o vírus Chikungunya chamada VLA1553-321. O imunizante se encontra na fase 3 dos estudos clínicos em voluntários maiores de 18 anos, em 44 locais dos Estados Unidos e tem mostrado bons parâmetros de segurança e soroproteção de 98,5% tanto em adultos quanto em idosos que receberam o imunizante de dose única. No Brasil, o ensaio clínico de fase 3 está sendo conduzido em oito estados em adolescentes de 12 a 17 anos que tenham ou não contraído a doença, com autorização de seus responsáveis legais e após passar por uma triagem clínica com base no histórico médico, exame físico e testes laboratoriais. O objetivo da pesquisa é verificar o perfil de segurança em pessoas de diferentes idades ( https://www.epsjv.fiocruz.br/podcast/).
Glossário
-
Anticorpos monoclonais
Proteínas produzidas pelo nosso organismo que ajudam o sistema imunológico a combater vírus, bactérias e câncer por meio do reconhecimento de antígenos. -
Anticorpos neutralizantes
Anticorpos capazes de impedir e neutralizar a ligação do vírus ao receptor da célula hospedeira. -
Artrópodes
Animais dotados de patas articuladas que se alimentam de sangue. Compreendem os insetos (6 patas na fase adulta) e os carrapatos (8 patas). -
Biogênese
Palavra de origem grega que significa origem da vida. É a produção de novos organismos ou organelas vivas. -
Célula hospedeira
Sistema vivo estável ao qual um agente patógeno (vírus, bactérias, protozoários, entre outros) se acopla utilizando nutrientes, proteínas e outras macromoléculas para se multiplicar. -
Chaperonas
Termo coletivo utilizado para proteínas que impedem o dobramento incorreto de uma proteína-alvo. -
Competência vetorial
Capacidade de uma população de mosquitos de se infectar e transmitir um vírus após o período de incubação extrínseco (EIP). Depende das características do vetor, do vírus e da temperatura ambiente. -
Comorbidades
Associação de duas ou de várias doenças que aparecem de modo simultâneo em um mesmo paciente. -
Culicídeo
Mosquitos da família Culicidae. -
Doença exantemática
É uma doença infecciosa sistêmica onde as manifestações cutâneas estão presentes no quadro clínico. -
Exantema maculopapular
Tipo de exantema caracterizado por uma área vermelha e plana na pele com pápulas pequenas e confluentes. -
Imunogenicidade
Capacidade que uma substância tem de induzir uma resposta imunológica. -
Imunogenético
Ativação do sistema de defesa de um organismo contra agente patógeno determinado pelas condições genéticas. -
Mutação
Mudança nos ácidos nucleicos que ocorre no material genético. -
Nucleotídeo
Molécula composta de uma base purina ou pirimidina ligada a uma pentose (ribose ou desoxirribose) e a um ou mais grupos fosfatos. -
Período de incubação extrínseco (EIP)
Tempo entre 8 e 10 dias após o qual o mosquito torna-se capaz de transmitir o vírus a um hospedeiro. -
Plasticidade genética
Propriedade dinâmica do genoma que pode envolver ganho, perda ou rearranjo de ácidos nucleicos. -
Pleomórfico
Que pode assumir várias formas. -
Pirimidinas
Compostos nitrogenados que contêm um anel heterocíclico. A citosina está presente no DNA e RNA; a timina se encontra no DNA; e o uracil substitui a timina no RNA. -
Purina
Compostos nitrogenados que contêm dois anéis heterocíclicos fusionados e formam parte dos ácidos nucleicos adenina e guanina. -
Propriedades antigênicas
Característica do antígeno, relacionada com a própria estrutura da molécula que ao ser induzida no organismo pode produzir anticorpos. -
Rash
Erupção cutânea. -
Repasto sanguíneo
Nome dado ao comportamento de mosquitos hematófagos que realizam atividade de se alimentar do sangue de outros animais. -
RNA polaridade positiva
A fita serve como RNA mensageiro para a síntese direta das proteínas. -
Saúde pública
Conjunto de medidas executadas pelo Estado para garantir o bem-estar físico, mental e social da população. -
Síndrome de Guillain-Barré
Doença autoimune que provoca danos no sistema nervoso periférico, com perda do isolamento de mielina, resultando em mialgia, paralisia facial e disfunção muscular. -
Vesículas
Elevações epidérmicas circunscritas. -
Viremia
Presença de vírus no sangue circulante do animal. -
Virulência
Capacidade de um agente infeccioso de se multiplicar no organismo do hospedeiro, produzir toxinas e levar a efeitos deletérios graves e/ou fatais. -
Zoonose ou doença zoonótica
Doenças e infecções que são naturalmente transmitidas de animais vertebrados para o homem.